Photozipperタンパク質のLOVドメインに形成されるフラビンラジカルの形成過程
Tsukuno,H., Ozeki, K., Kobayashi,I., Hisatomi, O. and Mino, H.,"Flavin
Radical Formation
in the Light-Oxygen-Voltage-sensing Domain of the Photozipper
Blue-light Sensor Protein, J. Phys.Chem. B (2018)
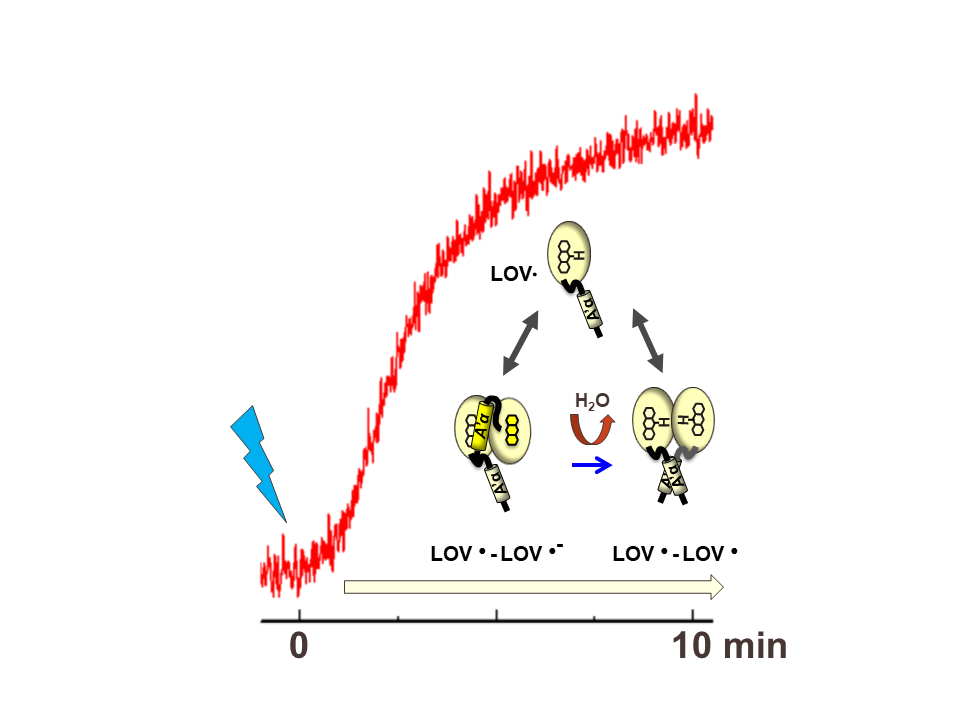
光センサータンパク質Photozipperは青色光照射によりLOVドメインが2量体化を起こし
特定のDNA配列に結合する転写因子です。遺伝子改変により外部電子donorとプロトンdonorを
供与することによって安定なフラ分ラジカルを形成することがわかっています。 しかしラジカル
形成のkineticsはロジスティック関数としてあらわされる非常にユニークな変化を示しました。
この論文ではラジカル形成と二量体構造形成との関連を議論しています (2018年)
ENDOR法による光合成光化学系II のCa2+の局所構造の解析
Nagashima, H. and Mino, H. ”Local structural modification of Ca2+-depleted Photosystem II detected by proton matrix ENDOR” Applied Magnetic Resonance (2018) in press.
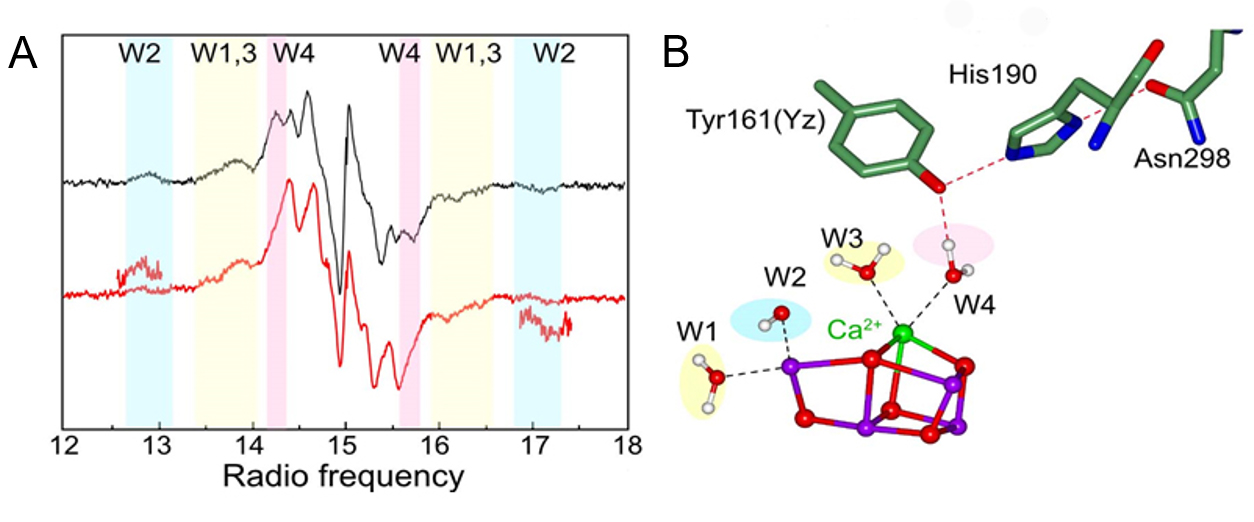
Ca2+は酸素発生系マンガンクラスターに含まれる酸素発生に重要なイオンです。Ca2+を除去したマンガンクラスターの電子状態の変化からCa2+の役割を考察しました。
光化学系IIのPsbPの位置のPELDOR法による解析
Asada, M., Nishimura, T., Ifuku, K. and Mino, H.” Location of the Extrinsic
Subunit PsbP in Photosystem II Studied by Pulsed Electron-Electron Double
Resonance”, Biochim. Biophys. Acta, (2018) 1859, 394-399.
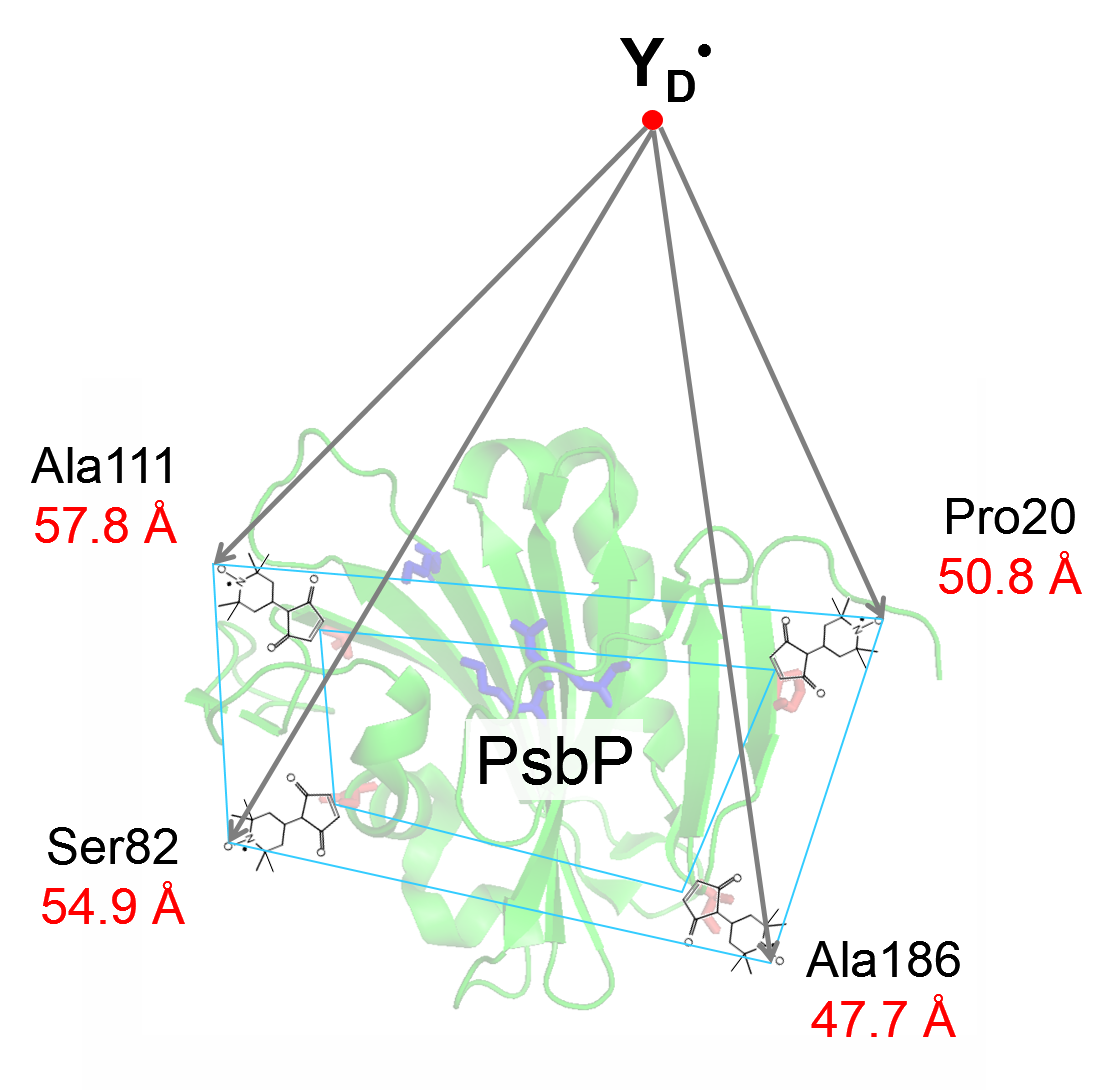
PebPタンパク質は光合成光化学系II の酸素発生にも働いている表在性タンパク質です。PELDOR法によって光化学系II への結合構造を解析しました。
光センサータンパク質Photozipperのactive状態での二量体構造
Ozeki, K., Tsukuno,H.,Nagashima, H., Hisatomi, O. and Mino, H "Dimeric Structure of the Blue Light Sensor Protein Photozipper in the Active State" Biochemistry,(2018)57,494-497.
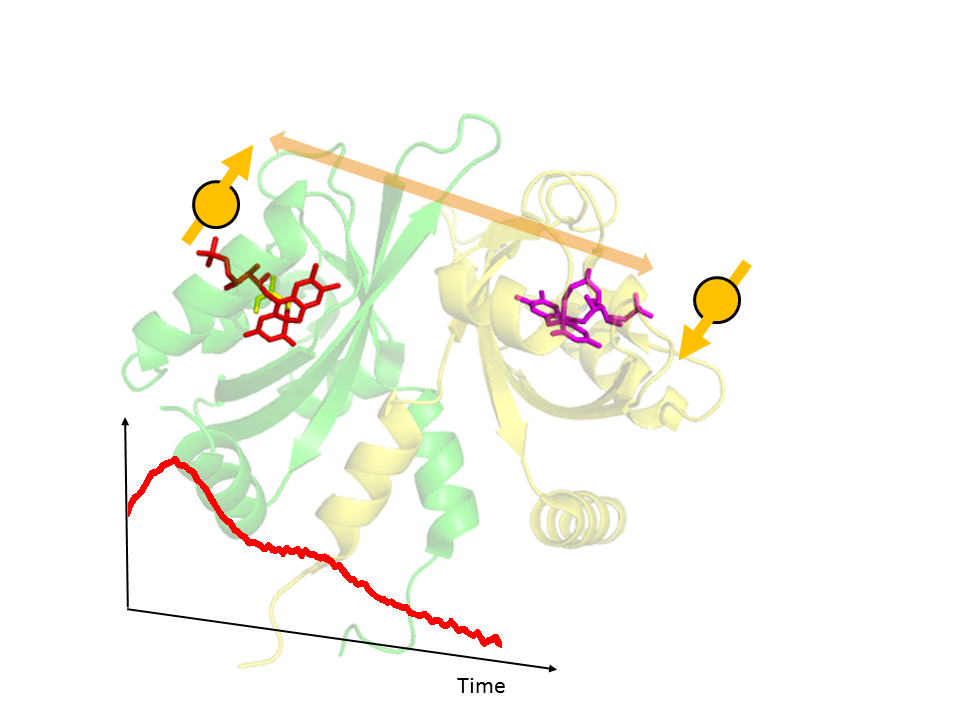
光センサータンパク質Photozipperは青色光照射によりLOVドメインが2量体化を起こし特定のDNA配列に結合する転写因子です。 構造についてはいくつかのグループが異なった結晶構造を発表しています。
この研究ではPELDOR法の用いてPhotozipperの構造を明らかにしています。
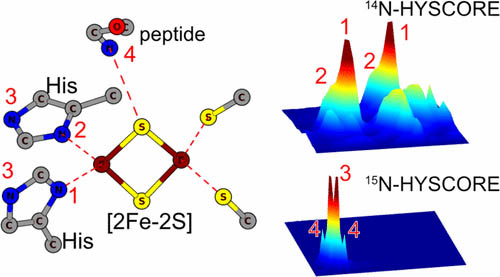
HYSCOREによるChlorobaculum tepidumのRIESKEタンパク質の窒素配位環境
Hyperfine Sublevel Correlation Spectroscopy Studies of Iron–Sulfur Cluster
in Rieske Protein from Green Sulfur Bacterium Chlorobaculum tepidum, Hiroki
Nagashima, Hiraku Kishimoto, Risa Mutoh, Naotaka Terashima, Hirozo Oh-oka,
Genji Kurisu, and Hiroyuki Mino
J. Phys. Chem. B, 2017, 121 (12), pp 2543–2553
RIESKEタンパク質は光合成系に見られるタンパク質ですがChlorobaculum tepidumのRIESKEはそれらとは系統がかなり異なるユニークな存在です。
このたんぱく質についてHYSOCRE測定を行いFeへの窒素の配位環境を明らかにしました。
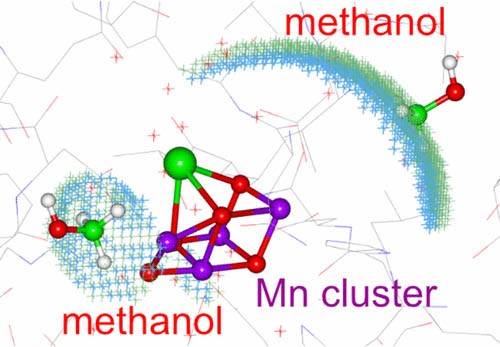
マンガンクラスター近くのメタノールの位置
Location of Methanol on the S2 State Mn Cluster in Photosystem II Studied by Proton Matrix Electron Nuclear Double Resonance, Hiroki Nagashima and Hiroyuki Mino, J. Phys. Chem. Lett., 2017, 8, pp 621–625
光化学系Ⅱは水を分解して酸素を発生する働きをもっています。少量のメタノールを加えると酸素発生はそのままでマンガンクラスター近傍に近づきクラスターの構造を変えることがわかっています。 メタノールによる摂動は水分解反応を解く手がかりになります。しかしその場所については様々な説があり明らかではありませんでした。この研究ではENDOR法を用いてマンガンクラスター近傍のメタノール位置を求めました。 わかっている結晶構造と照らし合わせると、その結合位置が明らかになりました。
紹介ビデオがあります:
http://pubs.acs.org/doi/suppl/10.1021/acs.jpclett.7b00110 へのリンク
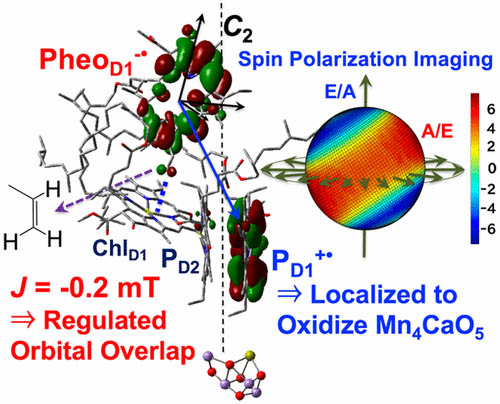
光化学系Ⅱの初期電荷分離の機構
光化学系Ⅱは光によってエネルギーが集められクロロフィル上で電荷分離をおこします。その電子移動をおこしラジカル対P680+Pheo-をつくります。 これ以上の電子移動が妨げられる場合、電子は戻ってきて3P680(三重項)を形成します。 この過程でのラジカル対の性質から、光化学系Ⅱ初期電荷分離特有の性質を見出しました。
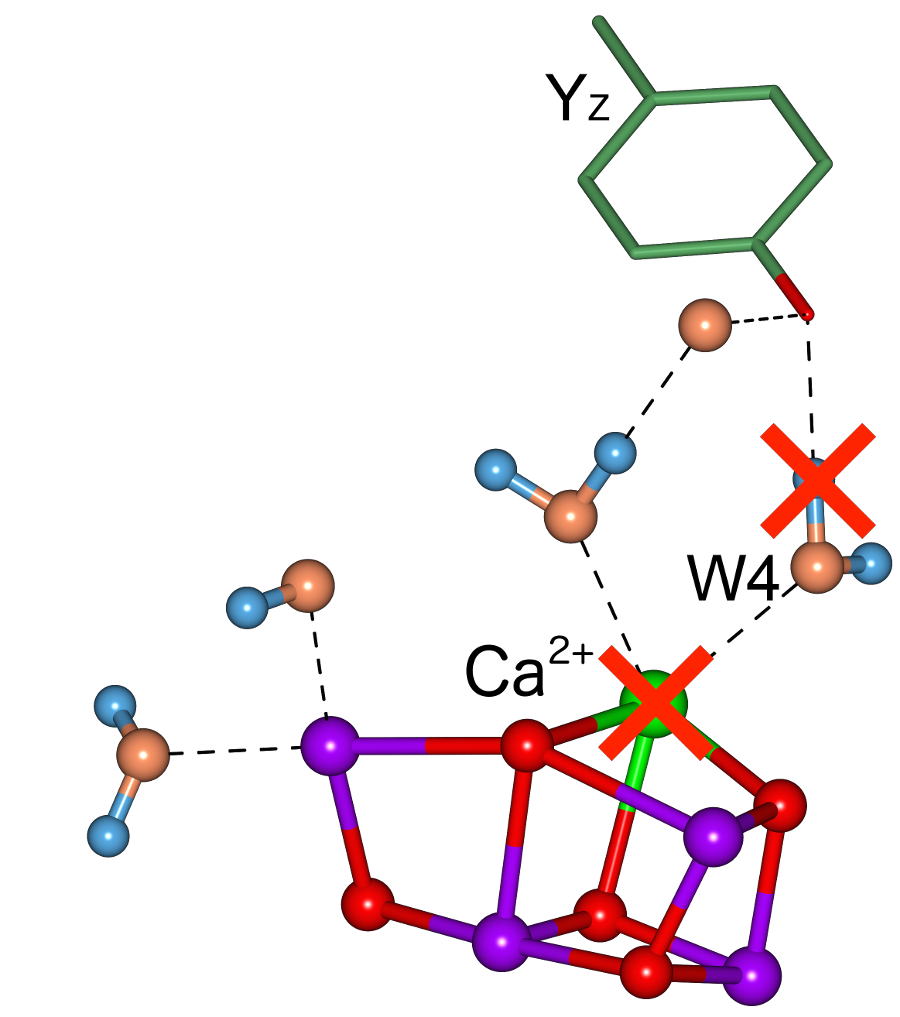
酸素発生系のCaのはたらき
Nagashima,H., Nakajima, Y., Shen, J-R. and Mino, H. ” Proton matrix ENDOR studies on Ca2+-depleted and Sr2+-substituted Mn cluster in photosystem II” J. Biol. Chem., (2015) in press.
光化学系Ⅱの酸素発生系マンガンクラスターの歪んだ椅子構造の中にはCaが位置しています。しかしCaは除去してもS2状態までの電子状態はほぼ変わりません。 ENDOR法をもちいてCaに配位している水のプロトン信号をとらえることに成功しました。YD-Ca-Mnクラスターを結ぶ経路はプロトン経路というだけでなく電子移動にも関与しています。
光活性のMnの結合サイトの決定
(M. Asada and H. Mino "Location of the High-Affinity Mn2+ Site in Photosystem II Detected by PELDOR
J. Phys. Chem. B., (2015) 119 (32), 10139-10144)
光化学系Ⅱの酸素発生系マンガンクラスターはマンガンクラスターを失った状態でマンガンなどの材料を加え光照射することによって構築されます。これを光活性化と呼びます。光化学系Ⅱには光活性化の一番初めにマンガンが結合する特別なサイトが存在し光酸化されることがわかっています。この結合サイトの位置をPELDOR法で決定しました。
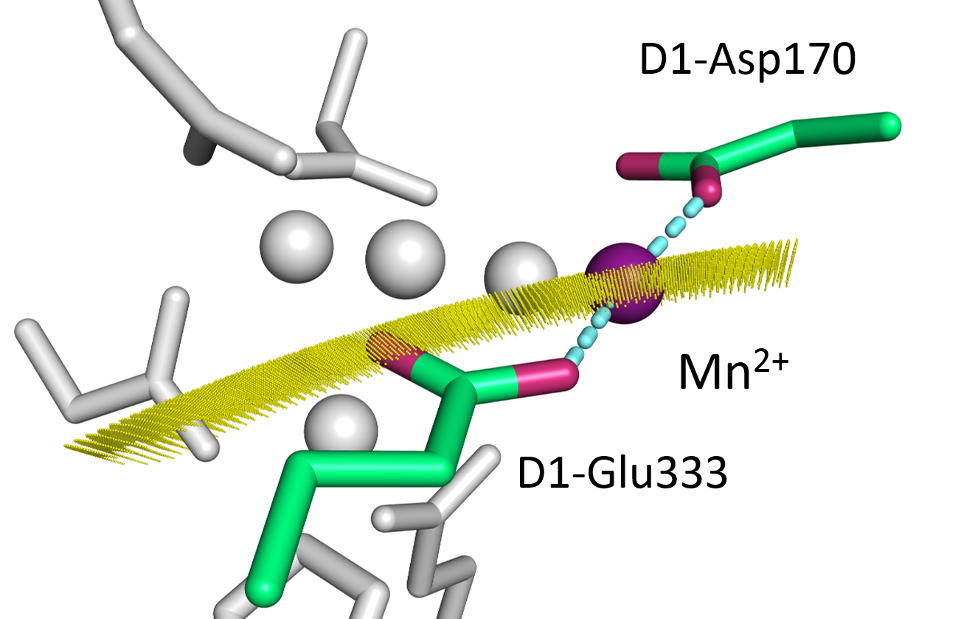
Mn2+の結合サイトは、光化学系Ⅱの結晶構造と比較するとマンガンクラスター中ではdumpling Mnと呼ばれるMn4の位置と一致しました。
酸素発生系S2状態でのマンガンクラスター周辺のプロトン位置を決める
(H. Nagashima and H. Mino "Highly resolved proton matrix ENDOR of oriented
photosystem II membranes in the S2 state", Biochim. Biophys. Acta,(2013) 1827,1165-1173)
ENDOR法は核―電子間の相互作用を観測する方法でプロトン位置を検出することができます。
CW-ENDOR法を用いて酸素発生系マンガンクラスター周辺の水のプロトンを検出しました。
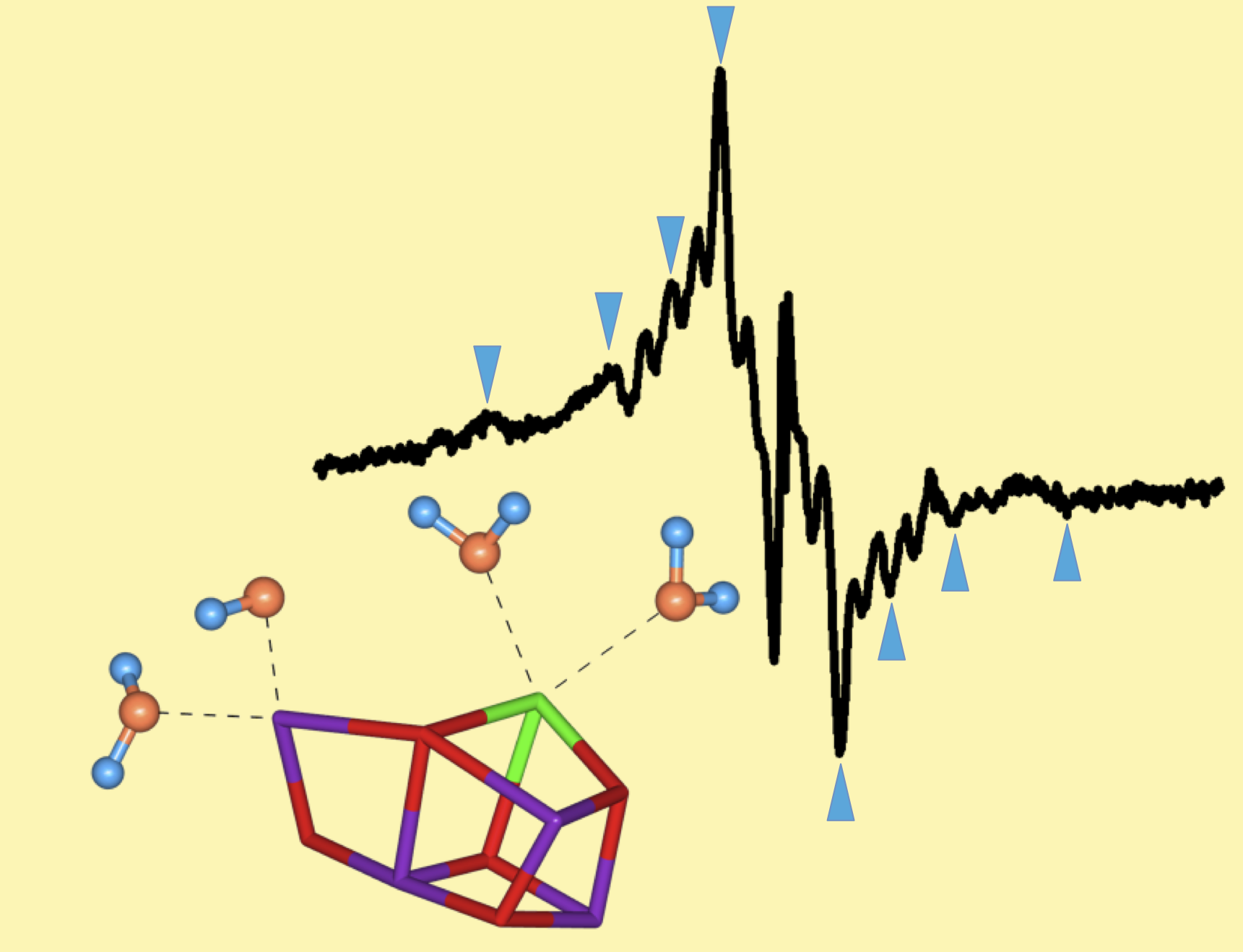
S2状態のMnクラスターのプロトンENDOR
マンガンクラスターに配位している水の信号が観測されている
酸素発生系S2状態の価数とスピン状態を決める
("Electronic structure of S2 state of the oxygen-evolving complex of photosystem II studied by PELDOR", Biochim. Biophys. Acta (2013))
2011年に、岡山大学らのグループによって光合成酸素発生系の構造が解明されました。 それによってS1状態での酸素発生系の構造、マンガンの配置や周辺アミノ酸の構造も明らかになりました。 しかしマンガン原子の価数は構造からだけではわかりません。 この研究では、PELDOR法を用いて結晶構造のデーターに基づいて、S2状態でのマンガンの価数やスピン間相互作用を決定しています。 結晶構造の座標データーから直接マンガン価数や相互作用を決定した研究です。

PELDOR法により決められたS2状態でのMnの価数原子の交換相互作用
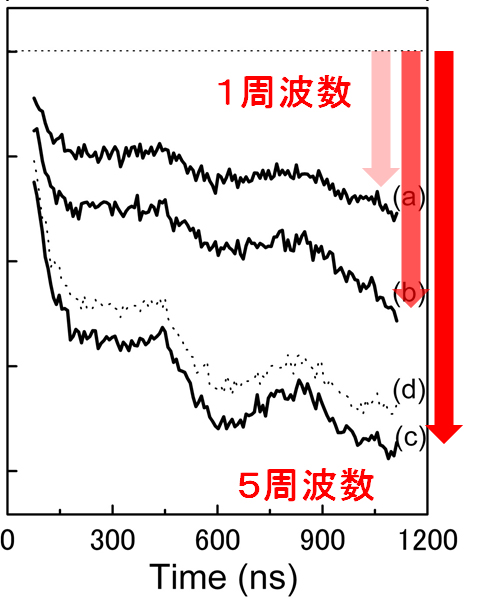
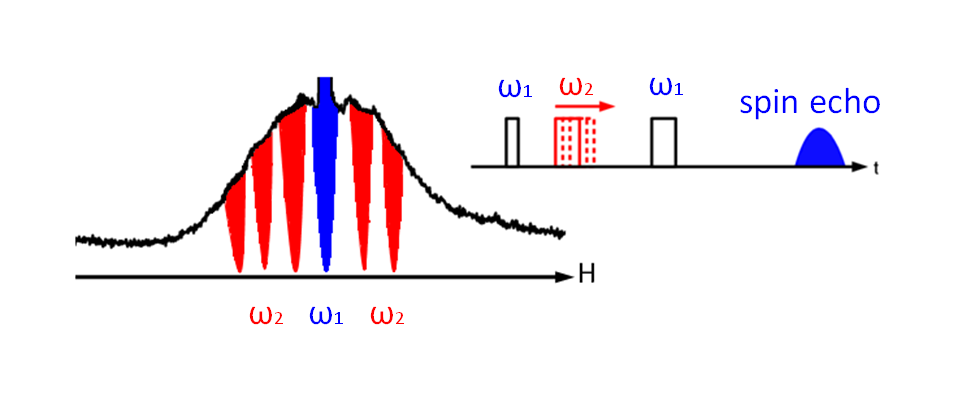
多周波を混合したパルスEPR法 ("Nonselective excitation of pulsed ELDOR using multi-frequency microwaves"J. Magn. Reson. (2011))
パルス磁気共鳴法の特徴は、幅をもった周波数で励起を行うことができる点にあります(参考)。 しかしEPR信号の線幅は一般に大変広く、一度にすべての信号を観測することはできません。 ですから通常はスペクトルの一部のみを観測していることになります。信号線形を山とするとちょうど山に穴を掘ったようなイメージになります(hole
burning)。 したがってもっと広い幅で穴を掘ることができればできることの可能性が広がります。 この研究ではパルスEPR法において穴を広げることの効果を調べました。 方法の評価は光合成光化学系ⅡのYD-マンガンクラスター間のPELDOR信号の大きさで行いました。 その結果、穴の数を増やすことによって信号強度が増加することを確認することができました。 今後様々な応用ができると考えられます。
G研-ESR teamの活動状況 Mailto:mino[at]bio.phys.nagoya-u.ac.jp ([at]は@に置き換えてください)