
|
|
|---|---|
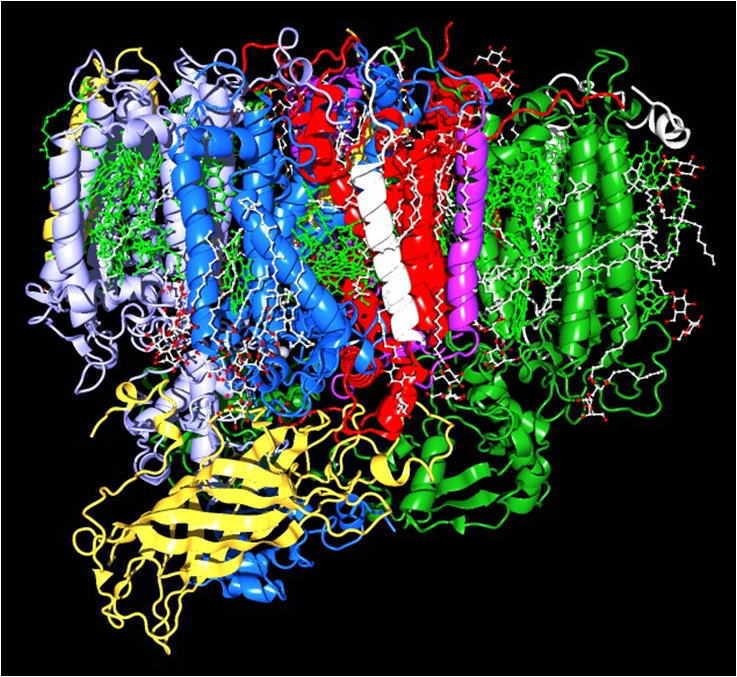
| 光合成による光エネルギー変換は、クロロフィルなどの色素やマンガンなどの金属を結合した光化学系と呼ばれる超分子蛋白質複合体において行われます。そこではクロロフィル励起状態からの電荷分離、及びそれに続く電子移動・プロトン移動がfsから秒オーダーの時間で連続して起こります。光合成生物は、これらの過程を精密に制御して行うことによって、非常に高い量子効率のエネルギー変換を実現しています。私達は、この生体光エネルギー変換システムの動作原理を原子・分子レベルで解明します。 | |
 |
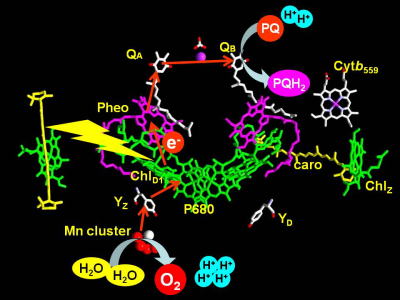 |
| 光化学系Ⅱ蛋白質複合体の構造 | 光化学系Ⅱの電子伝達経路 |
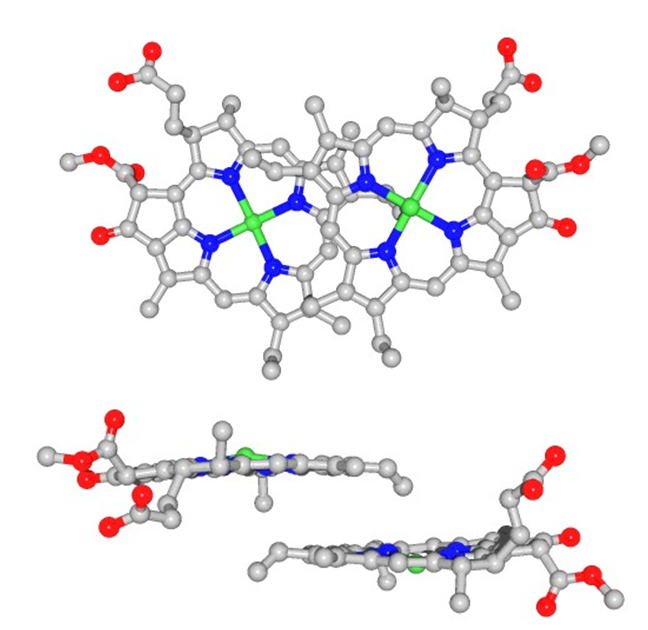 |
スペシャルペアクロロフィルの高い酸化還元電位の発現機構 光合成反応による光エネルギーから電気エネルギーへの変換は、反応中心蛋白質における光誘起電荷分離によって引き起こされます。電荷分離によって形成された二量体クロロフィルP680のラジカルカチオン極めて高い酸化還元電位(約1.2 V)を持っており、水の酸化による酸素発生を可能にします。FTIR法や量子化学計算、近傍アミノ酸への部位特的変異導入を用いて、二量体クロロフィル上の電荷はD1タンパク質側に偏って存在し、その偏りが高い酸化還元電位の一要因であることを明らかにしました(Nagao et al., J. Biol. Chem., 2017)。 |
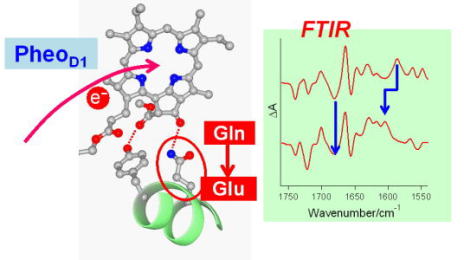
| フェオフィチン電子受容体の酸化還元コントロール 第一電子受容体として働くフェオフィチン分子の酸化還元電位は、電荷分離反応及び電荷再結合反応の効率を決める重要な要素です。このフェオフィチンの電位がケトC=O基の水素結合の強度によってコントロールされていることを明らかにしました。 |
 |
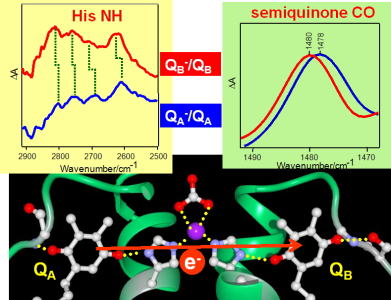 |
キノン電子受容体の電子・プロトン移動反応の分子メカニズム
水から放出された電子はキノン電子受容体QAおよびQBに渡され、プロトンを結合してキノールを生成し、膜中に遊離します。QAからQBへの電子移動反応は、それらの酸化還元電位によってコントロールされています。キノン分子とそれを取り巻くタンパク質との相互作用や水素結合ネットワークによって、QAおよびQBの酸化還元電位を決定するしくみが次第に明らかになってきました。 |
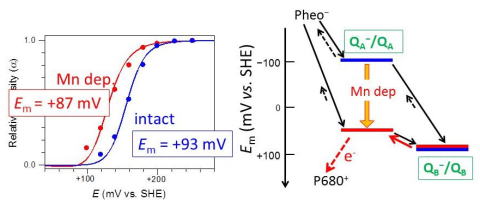
| 末端キノン電子受容体の酸化還元電位と電子移動制御 末端キノン電子受容体QBの酸化還元電位の直接測定は難しく、これまでその正確な値は明らかにされていませんでした。我々は、FTIR分光電気化学計測を用いることにより、初めてQBの酸化還元電位の直接測定に成功しました。さらに、Mnクラスター破壊のQBの酸化還元電位への効果を調べることにより、QBからのQAへの逆電子移動による光防御機構が明らかになりました(Kato et al., Proc. Natl. Acad. Sci. U.S.A., 2016)。 |
 |
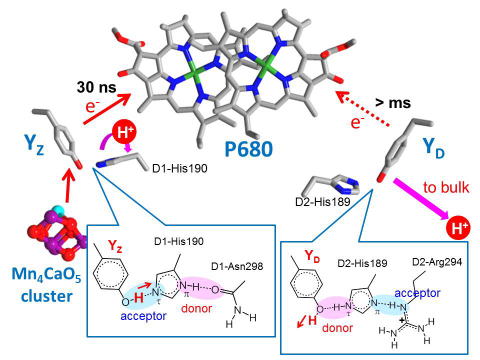 |
チロシン電子供与体YZ,YDの電子・プロトン移動反応と対称性
クロロフィル二量体P680への電子供与体として働く2つのチロシン残基、YZ,YDは対称的な位置に存在しますが、その反応は非対称であることが知られています。YZは速い電子移動により、水分解触媒であるマンガンクラスターからP680への電子移動を仲介しますが、YDは遅い電子移動により、副次的電子供与体として働きます。FTIR解析および量子化学計算により、YZ,YDの非対称的な反応は、電子移動に共役するプロトン移動反応の違いに起因することを明らかにしました(Nakamura et al., Biochemistry, 2014, Nakamura and Noguchi, Biochemistry, 2015)。 |
| 植物や藻類は光エネルギーを用いて水を「電気分解」し、酸素を発生させます。我々の呼吸に必要な21%の大気中酸素はこの光合成酸素発生によって供給されています。酸素発生反応は光化学系Ⅱに結合したマンガンクラスターと呼ばれる金属クラスターで行われることが分かっています。しかし、水分解反応の反応メカニズムは現在でも解明されておらず、光合成研究の最大の謎として残されています。私達はこの謎の解明に挑戦しています。光合成水分解機構の解明は、光エネルギーを用いた人工水分解デバイスの開発への基盤となる知見を与えます。 | |
 |
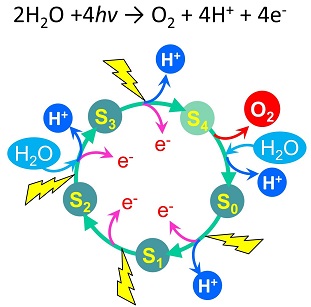 |
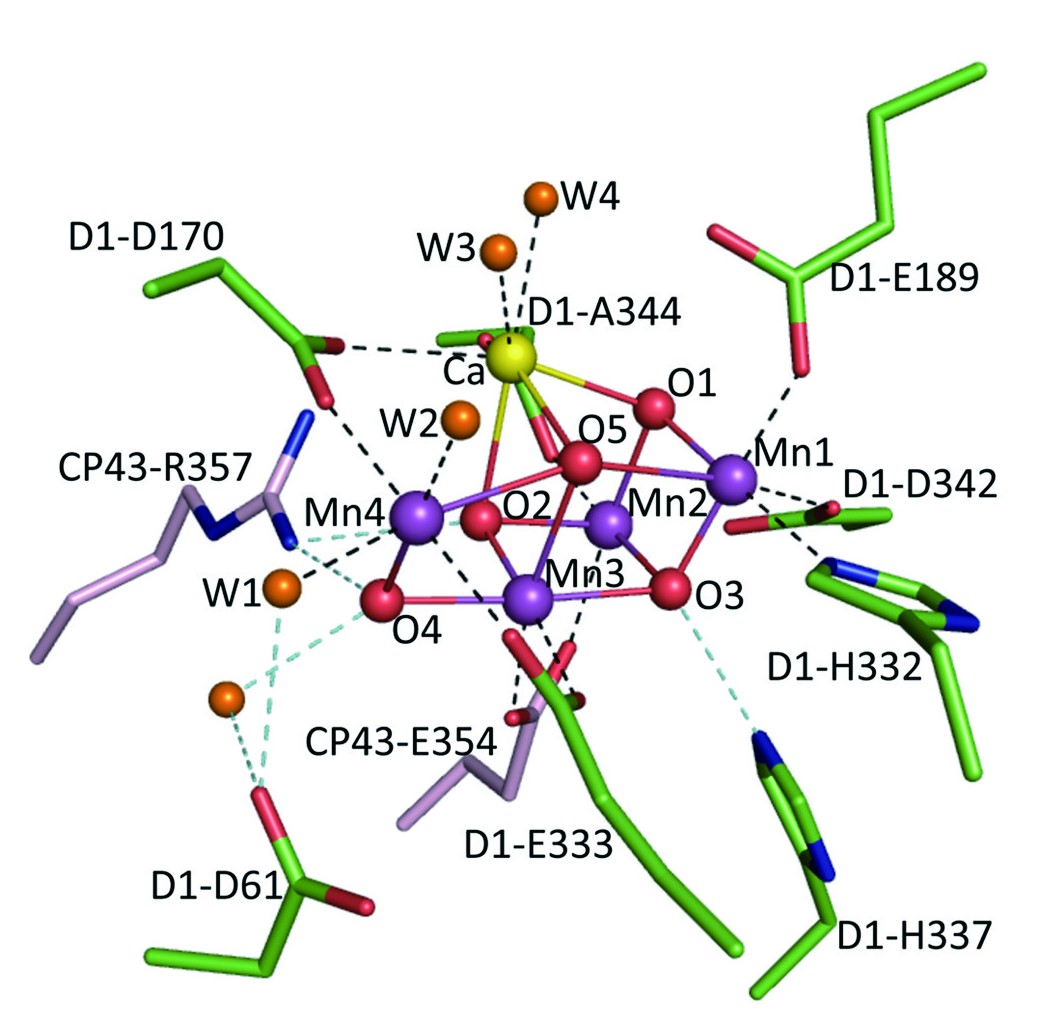
| 酸素発生マンガンクラスターのX線構造モデル(Umina et al., 2011) | 水分解(酸素発生)反応の光駆動4電子サイクル(S状態サイクル) |
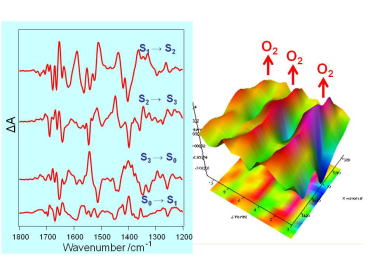 |
閃光誘起FTIR差スペクトルによる水分解系の構造変化の検出 閃光誘起FTIR差スペクトル法を用いて、水分解反応サイクルにおけるマンガンクラスター周辺の蛋白質の構造変化を捉えることに初めて成功しました。それによって、マンガンクラスターのアミノ酸配位子が周期的に構造変変化を起こして反応に関与することが明らかとなりました。 |
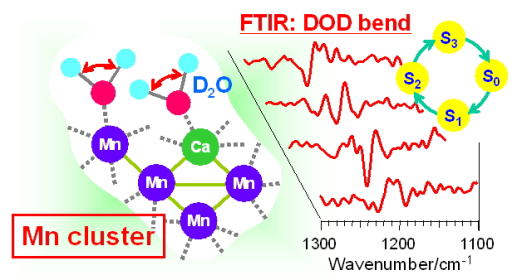
| 水分解反応における基質水分子の直接検出 閃光誘起FTIR法を用いて水のOH伸縮振動やDOD変角振動を検出することにより、水分解反応の際の水分子の動きを直接調べる手法を確立しました。 |
 |
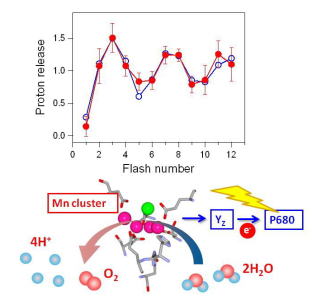 |
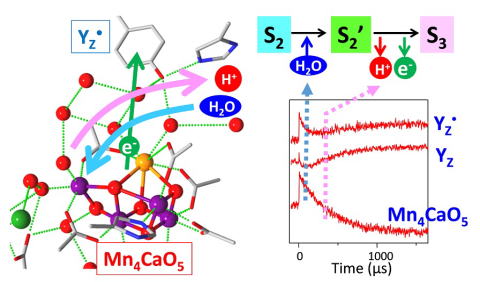
水分解反応におけるプロトン放出の検出 水分解反応によるプロトン放出を、緩衝剤の赤外検出による検出することに成功しました。その結果、プロトンはS0→S1:S1→S2:S2→S3:S3→S0遷移においてそれぞれ、1:0:1:2個放出されることが明らかとなりました(Suzuki et al., J. Am. Chem. Soc., 2009)。 |
| 中間状態遷移における電子・プロトン移動の時間分解赤外検出 時間分解赤外分光法を用いて、水分解反応の中間状態遷移における電子、プロトン、および水分子の移動の時間挙動を検出し、その分子メカニズムを明らかにしました(Sakamoto et al., J. Am. Chem. Soc., 2017)。 |
 |
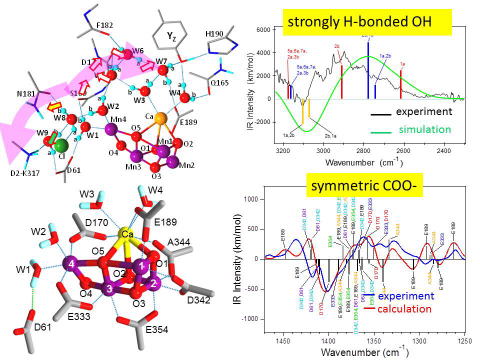 |
量子力学/分子力学計算によるMn4CaO5クラスターの振動構造 量子力学/分子力学(QM/MM)法を用いた計算によって、水分解触媒であるMn4CaO5クラスターのアミノ酸配位子や近傍に存在する水クラスターの振動構造を明らかにしました。それにより、水分子の水素結合ネットワークや、MnとCaを架橋するカルボキシル配位子が水分解反応に重要な役割を果たすことが示されました(Nakamura et al., Biochemistry, 2016; Nakamura and Noguchi., Proc. Natl. Acad. Sci. U.S.A., 2016)。 |
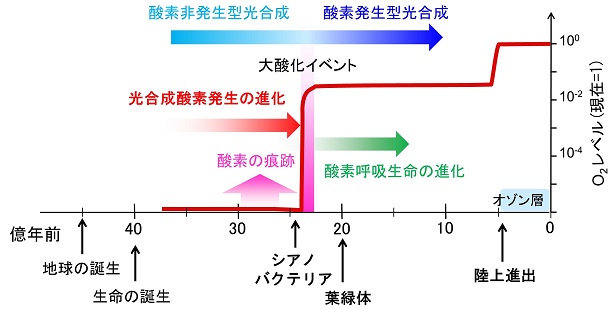
| 約40億年前の生命が誕生した頃の地球大気にはほとんど酸素が含まれていなかったと考えられています。しかし、24億年程前に、シアノバクテリアが水を分解して酸素を発生する酸素発生型光合成を完成させたことにより、地球大気の酸素濃度が急上昇して(「大酸化イベント」)、酸化型大気が形成されていきました。その後、シアノバクテリアは真核生物に共生して葉緑体となり、植物へと進化していきます。シアノバクテリアや植物による酸素発生は、酸素呼吸生命を生み、生命の爆発的進化と多様化を促しました。光合成蛋白質はどのように進化してきたのか、シアノバクテリアはいつ、そして如何にして酸素発生を始めたのか、私達は、こうした光合成の進化過程を解明し、地球と生命の共進化について考えます。 | |
 |
|
| 光合成酸素発生による地球と生命の共進化 | |
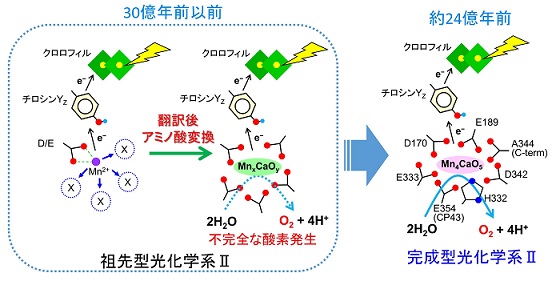
| 太古の地球の酸素の起源 我々は、マンガンクラスターのカルボキシル配位子(Asp, Glu)を遺伝子レベルで他のアミノ酸に改変すると、翻訳後にタンパク質レベルで本来のアミノ酸に変換され、酸素発生能が回復することを見出しました。この実験結果から、我々は、祖先型光化学系Ⅱにおいて、翻訳後アミノ酸変換によるカルボキシル配位子の生成によって、始原的なマンガンクラスターが形成されて低効率な酸素発生が起こり、これが太古の地球における酸素の起源になった、という全く新しい仮説を提唱しました(Shimada et al., Nature Communications 2022)。 |
 |
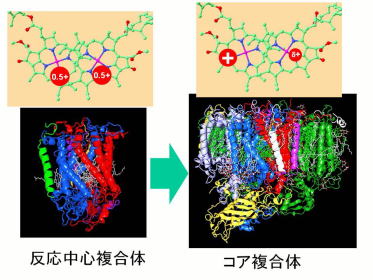 |
反応中心からコア複合体への進化―クロロフィルの酸化電位の上昇 FTIR法と量子化学計算により、非酸素発生型光合成を行う光合成細菌の反応中心蛋白質に相当するD1-D2-Cytb559光化学系Ⅱ反応中心複合体では、クロロフィル二量体上の電荷が広がって存在しており、水を酸化するほどの高い酸化還元電位を持たないことが明らかになりました。酸素発生を可能するためにさらに多くの蛋白質を結合したコア複合体が形成されたと考えられます。コア蛋白質形成によるクロロフィルの酸化還元電位の上昇メカニズムを明らかにしていきます。 |
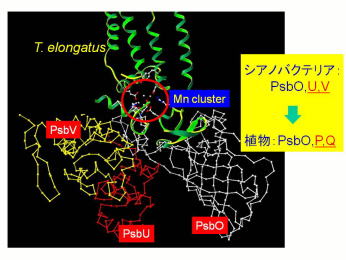
| 表在性蛋白質の進化 酸素発生系においてマンガンクラスターの安定化の役割を持つ表在性蛋白質はシアノバクテリアから植物への進化の過程で大きく変化していきました。この表在性蛋白質の進化においてその機能が如何に移行していったのかを調べます。 |
 |
| 植物は光をエネルギーとして利用していますが、逆に昼間の強光下では光合成能が落ちてしまうという現象(光阻害)が起こります。これは光反応によって有害な活性酸素が生成し、色素や蛋白質を壊す(光傷害)ことに由来します。そこで、光合成生物は、効率よく光エネルギーを変換するシステムとともに、余剰な光エネルギーを散逸させたり、活性酸素を生成させないための様々な光保護メカニズムを備え、光合成反応を制御しています。また、藻類などは、光を信号として用いて走行性を制御して環境の変動に対応するためのメカニズムを持っています。私達は、こうした光合成生物が持つ環境応答機構を解明する研究を行っています。 | |
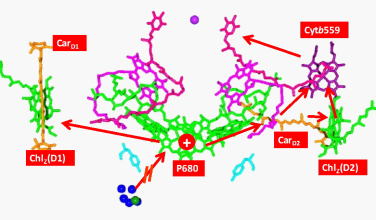 |
 |
| 光化学系Ⅱにおける副次的ホール移動経路 ―酸化的光傷害に対する光保護機構― |
青色光受容蛋白質PixD(シアノバクテリアの走行性の制御) |
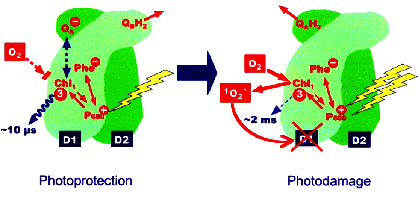 |
QA-ラジカルアニオンによる光保護機構 強光化において蓄積したQA-ラジカルアニオンにより、クロロフィル三重項励起状態の消光が起こり、活性酸素(一重項酸素)の生成が抑制される、という反応中心における光保護機構を提唱しています。 |
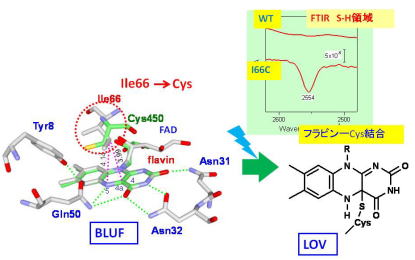
| 青色光受容体PixDのアミノ酸改変によるBLUFからLOV型反応への変換 フラビンを持つ青色光受容蛋白質にはBLUFとLOVということなく光反応機構を持つグループに分けられます。BLUF型蛋白質であるPixDの1アミノ酸を改変することにより、LOV型のフラビンーシステイン結合を形成する光反応へ変換できることを示しました。 |
 |
| 現在、人類が直面するエネルギー問題、環境問題、地球温暖化問題の解決の鍵を握るのは、高効率な人工光合成システムの開発です。植物やシアノバクテリアが行う光合成では、太陽光エネルギーを用いて水から電子を引き抜き、その電子を用いて二酸化炭素を還元して糖を合成しています。人工光合成では、光エネルギーと水の電子を用いて水素や一酸化炭素、メタンなどの燃料を直接合成します。私達の研究室では、極めて高い量子効率で水を酸化し、電子を獲得することのできる光化学系Ⅱ蛋白質を金属ナノ粒子に結合させることにより、ハイブリット型の人工水分解ナノデバイスを作ることに成功しました。このデバイスを用いて、水の光分解による水素発生や二酸化炭素還元による一酸化炭素やメタンの合成に挑戦します。 | |
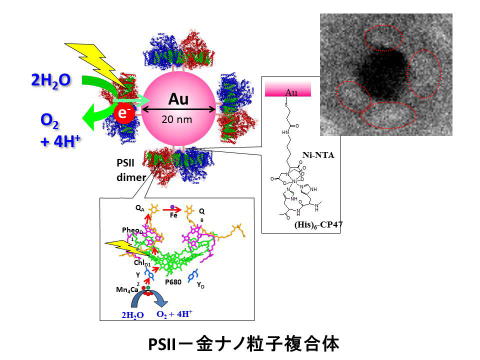 |
ハイブリッド型人工水分解ナノデバイス 好熱性シアノバクテリアの光化学系Ⅱ蛋白質を金ナノ粒子に結合させ、光エネルギーを用いて水から電子を獲得するハイブリット型人工水分解ナノデバイスを作成しました(Noji et al., J. Phys. Chem. Lett. 2011)。このデバイスにさらに水素発生触媒を共役させることにより、水の光分解による水素発生システムの開発を目指します。 |